ⓘ Inhaltsverzeichnis dieser Seite
Was ist eine Polycythaemia vera (PV) und wie häufig tritt sie auf?
Die Polycythaemia vera (PV) zählt zu den sogenannten klassischen chronischen myeloproliferativen Erkrankungen (MPN) des Knochenmarks. Dazu gehören neben der PV die Essentielle Thrombozythämie (ET), die präfibrotische Primäre Myelofibrose (präPMF) und die Primäre Myelofibrose (PMF).
Benennung
Der Name Polycythaemia vera leitet sich vom griechischen „polys“ für »viele«, „kytos“ für »Zellen« und „haima“ für »Blut« ab, außerdem vom lateinischen „vera“ für »wahr«.
Die myeloproliferativen Erkrankungen wurden von der Weltgesundheitsorganisation (WHO) mehrfach neu klassifiziert (zuletzt im Jahr 2022) und von ehemals Myeloproliferative Disorders (MPD) in Myeloproliferative Neoplasms (MPN – Myeloproliferative Neoplasien ) umbenannt.
In der Vergangenheit gebräuchliche, inzwischen aber veraltete Bezeichnungen wie Chronische Myeloproliferative Erkrankungen (CMPE), Osteomyelofibrose (OMF) und Chronische Idiopathische Myelofibrose (CIMF) werden selten, dennoch bis heute verwendet.
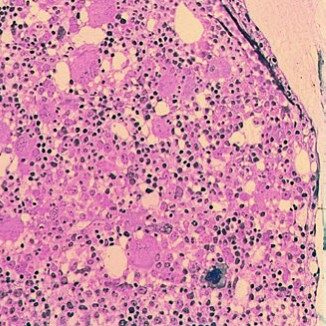
Unterscheidung von anderen Formen der MPN
Die verschiedenen Formen der MPN weisen viele Gemeinsamkeiten auf und lassen sich deshalb, insbesondere im Anfangsstadium, manchmal nur schwer voneinander unterscheiden. In einzelnen Fällen sind Übergänge von einer Subentität zur anderen möglich.
Häufigkeit
Die PV gehört zu den seltenen Erkrankungen (engl. orphan disease) mit einer Inzidenz zwischen 0.4 bis 2.8 Fällen pro 100 000 Einwohner pro Jahr in Europa. Hochgerechnet auf die Gesamtbevölkerung in Deutschland entspricht dies einer Zahl von etwa 1000-2000 Neuerkrankungen pro Jahr. Das erklärt, dass viele niedergelassene Ärzte die Erkrankung nicht kennen und selbst Fachärztinnen für Bluterkrankungen (Hämatologen) häufig nur wenige Patientinnen betreuen.
Erhöhter Hämatokrit bedingt häufig thromboembolische Ereignisse
Obwohl bei der PV in der Regel eine Vermehrung aller drei blutbildenden Zellreihen vorliegt (Vorstufen der roten Blutzellen, der weißen Blutzellen und der Blutplättchen), steht im Allgemeinen die chronische Überproduktion der roten Blutzellen (Erythrozyten) im Vordergrund. Das führt zu einem Anstieg des Hämatokritwertes, einem Gradmesser für das Verhältnis zwischen Zellen und flüssigen Bestandteilen des Blutes.
Der Normbereich liegt für gesunde Männer bei < 52 Prozent, für gesunde Frauen bei < 47 Prozent. Manche PV-Patienten weisen zum Diagnosezeitpunkt Werte von über 60 Prozent auf.
Sogenannte thromboembolische Ereignisse, wie zum Beispiel Thrombosen, Herzinfarkte, Schlaganfälle oder Embolien gelten als ernste und häufigste Komplikationen. Daher ist die engmaschige Kontrolle des Hämatokrits von entscheidender Bedeutung in der Behandlung der PV.
Was sind die Ursachen der Polycythaemia vera (PV)?
Die genauen Ursachen der PV sind bisher nicht bekannt. Es gibt aktuell keine gesicherten Erkenntnisse darüber, ob beispielsweise ein bestimmter Lebenswandel, der berufsbedingte Umgang mit Chemikalien oder sonstige Umwelteinflüsse die Entstehung einer PV begünstigen können.
Man geht davon aus, dass sie im Laufe des Lebens durch erworbene Mutationen in blutbildenden (hämatopoetischen) Stammzellen hervorgerufen werden kann. Diese Genmutationen führen dazu, dass diese Stammzellen ihre normale Funktion nicht mehr erfüllen. Die häufigste Mutation ist die JAK2V617F-Genmutation.
JAK2-Genmutation
Im Jahre 2005 entdeckten mehrere Forscherteams nahezu gleichzeitig, dass bei den MPN-Erkrankungen eine charakteristische Genveränderung auf dem Chromosom 9 vorliegen kann: die sogenannte JAK2-Mutation (JAK = Janus-Kinase).
Bei der Janus-Kinase handelt es sich um ein Protein (Enzym), das eine wichtige Rolle bei der Signalübertragung in der Zelle spielt. In Zellen, die diese Mutation tragen, ist das Enzym dauerhaft aktiviert, das heißt, der »Schalter« steht permanent auf »Ein«. In der Folge teilt sich die Zelle ununterbrochen, was im Fall der PV zu einer unkontrollierten und über den Bedarf weit hinaus gehenden Vermehrung insbesondere der Erythrozyten, aber auch von Leukozyten (weißen Blutkörperchen) und Thrombozyten (Blutplättchen) führt. Eine JAK2-Mutation lässt sich bei mehr als 95 Prozent der Fälle von PV-Patientinnen nachweisen. Neueste Untersuchungen geben Hinweise, dass die Mutation manchmal schon im Embryonalstadium oder Säuglingsalter nachweisbar ist, und dass es viele Jahre dauern kann, bis sich die Erkrankung entwickelt.
CALRETICULIN und MPL
Im Gegensatz zur ET, PMF und präPMF findet sich bei einer PV in aller Regel keine Calreticulin-Mutation (CALR) oder MPL-Mutation (Mutation im Gen für den Thrombopoetin-Rezeptor MPL).
Passenger-Mutationen
Zu den sogenannten Treiber-Mutationen (JAK2, CALR und MPL) können bei MPN eine ganze Reihe von zusätzlichen epigenetischen oder sogenannten Passagier-Mutationen eine Rolle spielen. Diese lassen sich allerdings nicht spezifisch der PV oder überhaupt einer MPN zuordnen, sondern werden auch bei anderen Knochenmarkerkrankungen gefunden. Manche davon (z.B. eine ASXL1-Mutation) können, unabhängig von der Art der Grunderkrankung, einen ungünstigen Einfluss auf die Prognose haben. Eine höhere Zahl JAK2 mutierter Stammzellen in Kombination mit einer hohen oder steigenden Anzahl nicht spezifischer Mutationen kann mit einem ungünstigeren Verlauf der PV einhergehen.
Ist eine PV vererbbar?
Nach dem jetzigen Stand der Forschung sind die MPN, also auch die PV, keine genetisch vererbten Krankheiten. Es können jedoch familiäre Dispositionen dafür auftreten. Bei familiären Häufungen von MPN über mehrere Generationen oder Erkrankungen an anderen hämatologischen Neoplasien oder weiteren Krebserkrankungen, wird gemäß Leitlinien der der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO) eine humangenetische Beratung empfohlen.
Welche Symptome können auf eine PV hinweisen?
Die Mehrzahl der Betroffenen lebt über viele Jahre oder sogar Jahrzehnte weitgehend beschwerdefrei. Zwischen dem Auftreten erster Symptome bis zur korrekten Diagnosestellung liegt häufig nochmals ein längerer Zeitraum.
Die häufigsten Beschwerden
Wenn Symptome auftreten, sind die häufigsten Beschwerden sogenannte Mikrozirkulationsstörungen, wie zum Beispiel Durchblutungsstörungen an Händen und/oder Füßen, Schwindel, Kopfschmerzen und Sehstörungen (Flimmersehen) oder Juckreiz, der insbesondere nach heißem Duschen oder Baden auftritt. Dieser aquagene Pruritus wird von vielen Betroffenen als besonders quälend empfunden und kann die Lebensqualität erheblich beeinträchtigen.
Da die meisten dieser Beschwerden auch unabhängig von der Erkrankung auftreten können, werden sie häufig erst im Rückblick mit der PV in Verbindung gebracht.
- Ohrensausen, Tinnitus (Ohrgeräusche)
- Kopfdruck, Gesichtsrötung
- Bluthochdruck (Hypertonie)
- Müdigkeit, Abgeschlagenheit
- Hauttrockenheit
- Nachtschweiß
- Wadenkrämpfe
- Glieder- und Knochenschmerzen
- Schmerzen in den Beinen
- Missempfindungen der Haut, z.B. das Gefühl, etwas würde über den Arm krabbeln
- Bläuliche Verfärbung, Schmerzen, Kribbeln, Brennen oder Taubheitsgefühle der Finger und/oder Zehenspitzen (Erythromelalgie)
- Blutergüsse (Hämatome), teilweise mit Verhärtungen/Schwellungen, die sich nur langsam zurückbilden
- Nasen- und Zahnfleischbluten
- Druckgefühl und/oder Schmerzen im linken Oberbauch (bei starker Milzvergrößerung)
- Atemnot (selten, bei Patientinnen mit Herz-Kreislauf-Erkrankungen)
Wie wird die PV diagnostiziert?
Häufig wird die Diagnose als Zufallsbefund oder in Folge eines thromboembolischen Ereignisses gestellt.
- Bei einer Routineuntersuchung oder im Rahmen der Diagnostik und Therapie anderer Erkrankungen fallen ein erhöhter Hämatokritwert oder dauerhaft erhöhte Thrombozyten auf.
- Patienten suchen eine Ärztin auf, weil sie unter Durchblutungsstörungen (Mikrozirkulationsstörungen), massivem Juckreiz vor allem nach Wasserkontakt (aquagener Pruritus) oder einer nicht erklärbaren chronischen Erschöpfung mit andauernder Müdigkeit, einer sogenannte Fatigue, leiden. Diese erkrankungsbedingte dauerhafte Erschöpfung wird inzwischen von MPN-Experten als wichtiges Kriterium in die Diagnostik einbezogen.
- Schwerwiegende Komplikationen wie eine Thrombose, ein Herzinfarkt oder ein Schlaganfall führen zur Diagnose PV.
Die Erfahrungen der Mitglieder des mpn-netzwerks zeigen, dass viele Ärzte die vielschichtige Gesamtsymptomatik zunächst nicht richtig einordnen, da Veränderungen des Blutbildes verschiedene Ursachen haben können. Mitunter werden sie sogar als Laborfehler eingestuft und ignoriert. Außerdem ist die PV – wie bereits erwähnt – noch immer relativ unbekannt. Eine Erhöhung des Hämatokrits, beziehungsweise der Blutwerte, kann häufig andere Ursachen haben. Diese werden Medizinerinnen, bevor sie eine Polycythaemia vera in Erwägung ziehen, zunächst abklären. Wichtig ist, dass von ärztlicher Seite frühzeitig an die Möglichkeit einer PV gedacht wird, vor allem dann, wenn die Werte über einen längeren Zeitraum erhöht bleiben.
Besteht der Verdacht auf das Vorliegen einer PV, sollte stets und baldmöglichst ein Hämatologe hinzugezogen werden. Dieser ist darin geschult, eine Diagnose auf Basis der aktuellen Behandlungsleitlinien der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO) zu stellen.
Wichtigstes Kriterium für die Diagnosestellung ist die Höhe des Hämoglobinwerts, bzw. des Hämatokrits. Eine erhöhte Thrombozytenzahl kann ebenfalls auf eine PV hinweisen.
Die PV Diagnosekriterien im Überblick
Hauptkriterien
- Hämoglobin >16,5 g/dl bei Männern, >16,0 g/dl bei Frauen oder Hämatokrit >49% bei Männern, >48% bei Frauen
- Trilineäre Myeloproliferation mit pleomorpher Megakaryopoese im Knochenmark – das bedeutet eine Steigerung aller drei Zellreihen (weiße und rote Zellen und Blutplättchen) mit vielgestaltigen Vorläuferzellen der Blutplättchen, sogenannten Megakaryozyten
- Nachweis der JAKV617F-Mutation oder einer anderen funktionell ähnlichen Mutation (z.B. im Exon 12 des JAK2-Gens)
Nebenkriterien
- Erniedrigter Erythropoetin (EPO)-Spiegel
Die Diagnose PV gilt als gesichert, wenn entweder alle drei Hauptkriterien oder die ersten beiden Hauptkriterien und das Nebenkriterium erfüllt sind.
Welche Untersuchungen werden bei der Diagnose durchgeführt?
Blutuntersuchung
Bei fast allen PV-Betroffenen weichen die Blutwerte von normalen Befunden ab: Neben dem Hämatokrit, dem Hämoglobin und den Erythrozyten sind häufig auch die Thrombozyten (> 400.000/µl) oder Leukozyten (> 10.000/µl) erhöht.
Wenn nur die Erythrozytenwerte erhöht sind, kann die Diagnosestellung erschwert sein. In diesem Fall muss ausgeschlossen werden, dass eine andere Ursache (nicht MPN) für die Vermehrung der Erythrozyten verantwortlich ist – etwa ein erhöhter Erythropoetinspiegel im Blutplasma oder ein Sauerstoffmangel durch Lungenerkrankungen oder Rauchen.
Bei Patienten, die zwar erhöhte Thrombozyten, aber noch einen normalen oder nur leicht erhöhten Hämatokrit aufweisen, muss geprüft werden, ob gegebenenfalls eine Essentielle Thrombozythämie (ET) vorliegt. Die diagnostische Absicherung ist wichtig, da sich die Art der Behandlung teilweise unterscheidet. In Einzelfällen gestaltet sich die Abgrenzung der verschiedenen MPN-Krankheitsbilder derart schwierig, dass eine sichere Unterscheidung in PV, ET, präPMF nur über die längerfristige Beobachtung des Krankheitsverlaufs möglich ist.
Molekulargenetische Untersuchungen
Ebenfalls im Rahmen der Blutuntersuchung erfolgt die molekulargenetische Analyse und zielt vor allem auf den Nachweis einer JAK2-Mutation ab. Bei mehr als 95 Prozent der PV-Betroffenen fallen entsprechende Tests positiv aus.
Der Nachweis der JAK2-Mutation sagt zunächst nichts darüber aus, um welche Myeloproliferative Erkrankung es sich handelt, da sie sowohl bei der ET als auch bei der PV und der präPMF bzw. PMF auftreten kann. Da nicht alle Erkrankten die Mutation tragen, schließt ein negatives Testergebnis eine MPN nicht sicher aus.
Ultraschall des Bauchraums
Da bei der PV mehr Zellen als normal gebildet werden und es somit zu einem erhöhten Zellumsatz kommt, kann die Milz bei vielen Betroffenen mehr oder weniger stark vergrößert (Splenomegalie) sein, in manchen Fällen auch die Leber. Im späteren Verlauf der Erkrankung kann auch eine zunehmende Verfaserung des Knochenmarks mit einer Verschiebung der Blutbildung in die Milz zu dieser Vergrößerung beitragen. Besonders eine stark vergrößerte Milz macht sich bei manchen Erkrankten durch diffuse Bauchbeschwerden bemerkbar. Oft fällt die Vergrößerung jedoch erst beim Ultraschall (Sonographie) auf.
Außer dem JAK2-Nachweis gilt die Knochenmarkpunktion (KMP) als wichtigste Methode, um eine PV eindeutig zu diagnostizieren und wird daher von Expertinnen als meist unumgänglich angesehen.
Die Ergebnisse der Knochenmarkuntersuchung sind für die weitere Behandlung und Prognose von großer Wichtigkeit, da die KMP die einzige Möglichkeit darstellt, die MPN genau zu unterscheiden. Die veränderten blutbildenden Zellen des Knochenmarks lassen sich nur unter dem Mikroskop genauer untersuchen. Deshalb empfiehlt es sich, die Gewebeprobe zusätzlich von einem spezialisierten Referenzlabor (Hämatopathologen) zweitbegutachten zu lassen.
Häufig liegt in der Frühphase der PV noch keine oder nur eine geringe Faservermehrung (Fasergrad ≤ 1) im Knochenmark vor. Allerdings findet sich ein hyperzelluläres Knochenmark, also eine gesteigerte Granulopoese, Erythropoese und Megakaryopoese. Im weit fortgeschrittenen Stadium zeigt die Untersuchung des Knochenmarks häufig eine deutliche Fibrosierung (Faservermehrung). Da eine PMF im Frühstadium ebenfalls eine erhöhte Zellzahl der Granulopoese und der Megakaryopoese aufweisen kann, ist eine KMP wichtig, um eine eindeutige Diagnose anhand des Fasergrads stellen zu können.
Wichtig zu wissen:
Letztlich stellt jede Knochenmarkpunktion nur eine Momentaufnahme dar, die in der Regel keine Aussage über den weiteren Verlauf der Erkrankung zulässt.
Welche Prognose hat die PV?
Prognoseangaben, insbesondere aus dem Internet, sind vielfach veraltet und daher irreführend.
Generell ist die Überlebensprognose einer gut kontrollierten PV günstig. Eine geeignete Therapie reduziert deutlich das größte Risiko, ein thromboembolisches Ereignis.
In den deutschen Leitlinien wird für die Einschätzung der individuellen Prognose weiterhin das Risiko für ein thromboembolisches Ereignis verwendet. Dieses Risiko erhöht sich durch ein biologisches Alter über 60 Jahren oder schon aufgetretene Thromboembolien. In neueren Prognosescores werden zusätzliche Passenger-Mutationen in die Prognostik einbezogen (z.B. MIPSS-PV). Allerdings werden diese neuen Prognosescores noch nicht flächendeckend angewendet und haben daher keine Auswirkungen auf die Indikationen für zytoreduktive Therapien.
Die Erfahrungen der Mitglieder des mpn-netzwerks zeigen, dass schlecht informierte Ärzte manchmal schockierende Angaben zur Lebenserwartung machen, die die Patientinnen stark verunsichern und unnötig Ängste schüren. Durch aufmerksames Beobachten und bei Bedarf einzuleitender Behandlung der Erkrankung kann die Lebenserwartung von PV-Patienten deutlich gesteigert werden.
Wie ist der Verlauf der PV?
Der natürliche Verlauf der PV ist in verschiedene Krankheitsstadien gegliedert:
Chronische (polyzythämische) Phase
Diese Phase dauert zumeist Jahre oder Jahrzehnte und ist gekennzeichnet durch gesteigerte Zellbildung im Knochenmark, hohe Zellzahlen im peripheren Blut und einem gegenüber Gesunden erhöhten Risiko für Thrombosen. Diese stellen bei unbehandelter PV die häufigste Todesursache dar. Selten kommt es zu lebensbedrohlichen Blutungen.
Eine Auslagerung der Blutbildung aus dem Knochenmark in andere Organe findet zu diesem frühen Zeitpunkt der Erkrankung in der Regel noch nicht oder nur begrenzt statt. Da jedoch die Milz an der Verarbeitung der übermäßig hohen Zellzahlen beteiligt ist, kann diese schon im frühen Stadium vergrößert sein und allmählich weiter wachsen.
Weiterer Krankheitsverlauf
Im weiteren Krankheitsverlauf kann es im Knochenmark neben einer Überproduktion von Blutzellen zu einer vermehrten Neubildung von Bindegewebe (Fibrose) kommen. Diese Faservermehrung wird wahrscheinlich von Entzündungsbotenstoffen (Zytokinen) begünstigt. Sie lässt sich als „Narbenbildung“ oder „Verödung“ des Knochenmarks beschreiben und kann zum allmählichen Versagen der Zellbildung im Knochenmark führen. Durch die zunehmende Verfaserung wird die Blutbildung teilweise in Milz und Leber verlagert und es kann zu einer Vergrößerung dieser Organe, insbesondere der Milz kommen.
Spätphase
In der Spätphase, oft nach Jahren oder Jahrzehnten, kommt es zum Rückgang der gesteigerten Zellbildung. Eine Transformation in eine (sekundäre) Post-PV-Myelofibrose und – selten – direkt von der PV in eine akute Leukämie kann folgen.
Im Zuge der fortschreitenden Fibrose kommt es zu einer Abnahme der Erythrozyten (Rückgang der Erythrozytose) und einer Zunahme der Milzgröße (Splenomegalie). So kann sich mit der Zeit eine Blutarmut (Anämie) einstellen. Die Leukozytenzahl kann zu diesem Zeitpunkt sowohl erhöht als auch erniedrigt sein. Später können sie ebenfalls abfallen. Die bei Gesunden etwa 4 × 7 × 11 Zentimeter große Milz kann im Verlauf der Erkrankung auf weit über 25 Zentimeter anschwellen und große Teile des Bauchraumes anfüllen, mit der Folge, dass andere Organe verdrängt und in ihrer Funktion beeinträchtigt werden.
Für die Patientin wird der Alltag in diesem fortgeschrittenen Stadium der PV häufig von einem deutlichen Krankheitsgefühl bestimmt, da sich eine Anämie meist durch Abgeschlagenheit, abnehmende Leistungsfähigkeit, Müdigkeit und Erschöpfung bemerkbar macht. Der Hämoglobingehalt nimmt mit Rückgang der Erythrozyten ebenfalls ab und kann im fortgeschrittenen Stadium Werte erreichen, die regelmäßige Bluttransfusionen notwendig machen. In der Regel spricht man dann aber nicht mehr von einer PV, sondern von einer sogenannten Post-PV-Myelofibrose. Diese kann weiter in eine akute myeloische Leukämie (AML) transformieren. Der direkte Übergang von einer PV zu einer AML ist möglich, aber selten.
Es ist wichtig, den individuellen Krankheitsverlauf kontinuierlich ärztlich begleiten zu lassen – am besten von einer auf die Behandlung von MPN spezialisierten Hämatologin. Diese ist in der Lage, Veränderungen im Blutbild rasch zu erkennen, die Vor- und Nachteile einer medikamentösen Behandlung sorgfältig abzuwägen und gemeinsam mit dem Patienten die optimale Therapie zu finden.
Welche Komplikationen können bei einer PV auftreten?
Bei einer PV müssen nicht zwangsläufig schwerwiegende Komplikationen auftreten. Allerdings ist die statistische Wahrscheinlichkeit höher als bei Nichterkrankten.
Ernste und häufigste Komplikationen äußern sich in erster Linie als sogenannte thromboembolische Ereignisse, wie Thrombosen, Schlaganfälle, Herzinfarkte oder Embolien. Verständlicherweise steigt das Risiko solcher Komplikationen mit der “Zähflüssigkeit” des Blutes.
Paradoxerweise kann bei einer sehr hohen Thrombozytenzahl (1-1,5 Mio.) die Blutungsneigung erhöht sein.
Wichtig zu wissen:
Sie können das persönliche Risiko für etwaige Komplikationen senken durch:
- eine aufmerksame Selbstwahrnehmung und zwingend erforderliche regelmäßige ärztliche Kontrollen
- das Beachten der allgemeinen Empfehlungen zur Begrenzung des Herzinfarkt- und Schlaganfallrisikos:
- nicht rauchen
- effektive Behandlung von Herz- Kreislauferkrankungen, Diabetes, hohem Cholesterinspiegel, etc.
- ausgewogene Ernährung
- Reduzierung des Übergewichts
- regelmäßige Bewegung, z.B. Ausdauersport, Venengymnastik
- ausreichende Flüssigkeitszufuhr, sofern nicht andere Krankheiten dagegen sprechen
- Besondere Maßnahmen bei längeren Autofahrten und Langstreckenflügen:
- genügend trinken
- sich immer wieder bewegen
- evtl. Kompressionsstrümpfe tragen
- ggf. Heparin spritzen (sprechen Sie Ihren Arzt hierauf an, ob und ab welcher Länge des Fluges und in welcher Dosis dies für Sie empfohlen wird)
Die Behandlung der PV
Wann sollte mit einer Behandlung begonnen werden?
Ausprägung und Verlauf der PV sind individuell sehr unterschiedlich, daher gibt es keine einheitliche Therapievorgaben für alle PV-Betroffenen.
Der richtige Zeitpunkt für den Behandlungsbeginn stellt häufig einen Kompromiss dar zwischen der Notwendigkeit, krankheitsbedingte Beschwerden zu lindern und Komplikationen vorzubeugen auf der einen Seite und dem Risiko medikamentöser Nebenwirkungen auf der anderen.
Es ist notwendig, die Erkrankungssituation der einzelnen Patientin und ihre sonstigen Begleiterkrankungen zu berücksichtigen. Verträglichkeit und Wirksamkeit der verschiedenen Medikamente sind ebenfalls individuell verschieden. Häufig ermöglicht erst ein Behandlungsversuch ein Urteil. Im Idealfall beraten sich Ärztin und Patient und finden gemeinsam die optimale Therapie heraus. Diese kann im langjährigen Verlauf durchaus wechseln.
Es gibt aber Faktoren, die in die Risikoabschätzung einfließen, hier eine Auswahl:
- Alter
- Dauer der Erkrankung und bisheriger Krankheitsverlauf
- Gab es bei der Patientin oder in ihrer Familie bereits gravierende Komplikationen, wie z.B. Thrombosen oder Blutungen?
- Bestehen PV-unabhängige Risikofaktoren für thromboembolische Ereignisse wie Rauchen, Pille, Gefäßerkrankungen, Diabetes, Übergewicht, etc.?
- Ist der Betroffene JAK2-positiv?
- Wie häufig sind Aderlässe notwendig? Werden die Aderlässe gut vertragen?
- Besteht ein symptomatischer Eisenmangel, der keine Fortführung der Aderlässe erlaubt?
- Liegt eine Milzvergrößerung vor und bereitet diese Probleme? (Oberbauchschmerzen, schnelles Sättigungsgefühl o. Ä.)
- Sind die Thrombozyten stark erhöht?
- Wie ist das Gesamtbefinden?
- Wie wird die Verträglichkeit von Medikamenten eingeschätzt? (Allergien, Autoimmunerkrankungen, Nebenwirkungen, etc.)
- Welche Nebenerkrankungen sind vorhanden?
Was sind die Ziele der PV-Therapie?
Es geht darum,
- bereits bestehende Symptome zu lindern und damit die Lebensqualität zu steigern
- das Thrombose- und Embolierisiko zu senken
- Blutungen zu verhindern
- Komplikationen wie den Übergang in eine Post-PV-MF oder Akute Myeloische Leukämie zu vermeiden
Wichtig zu wissen:
Gravierende Zwischenfälle, wie eine Thrombose, ein Herzinfarkt oder ein Schlaganfall, erfordern einen sofortigen Einstieg in eine Behandlung, um die Zellzahlen, insbesondere den Hämatokrit, umgehend und nachhaltig zu reduzieren. Nur so kann die akute Gefahr abgewendet und das Risiko weiterer Komplikationen minimiert werden.
Wie wird die PV behandelt?
Wichtig zu wissen:
Eine einheitliche Therapieempfehlung für alle PV-Patienten gibt es nicht!
Watch & Wait-Strategie meist verbunden mit einer Aderlasstherapie
Eine Watch & Wait-Strategie (beobachten und abwarten), verbunden mit der Aderlasstherapie und der Gabe von ASS (siehe Kapitel unten), ist die älteste, wirkungsvollste und nebenwirkungsärmste Behandlungsmöglichkeit der PV. In vielen Fällen (bei Patienten mit Niedrigrisikokonstellation) zunächst auch die Therapie der Wahl.
Zu Beginn der Erkrankung ist es unbedingt notwendig, den erhöhten Hämatokrit durch wiederholte Aderlässe abzusenken, um das Risiko von thromboembolischen Komplikationen rasch zu reduzieren. Danach reicht es in vielen Fällen aus, die Hämatokritwerte durch gelegentliche Aderlässe < 45% zu halten. Zusätzlich wird die prophylaktische Einnahme von Acetylsalicylsäure (ASS) in niedriger Dosierung empfohlen (50-100 mg/ Tag), da die vorbeugende Wirkung gegen Thrombosen bei PV-Patientinnen in einer Studie (ECLAP-Studie) eindeutig belegt wurde. Nur in begründeten Ausnahmefällen wird in der Behandlung der PV auf ASS verzichtet. Beim Auftreten von Durchblutungsstörungen in den kleinen Gefäßen (Mikrozirkulationsstörungen) wird zunächst beobachtet, ob die Symptome unter der Einnahme von ASS zurückgehen. Liegt eine gesteigerte Blutungsneigung vor, sollte initial auf ASS verzichtet werden, denn ASS verstärkt die Blutungsneigung. Je nach individueller Konstellation (z.B. aufgrund von Nebenerkrankungen, die eine ASS-Therapie aber erforderlich machen, kann dies auch dazu führen, dass man die Einleitung einer medikamentösen Therapie empfehlen wird.
Im Vergleich zum Hämatokrit gilt die Thrombozytenzahl bei der PV zwar als nachrangiger Risikofaktor, müssen aber dennoch beobachtet werden. Da Thrombozyten über eine Million das Blutungsrisiko erhöhen können, stellen sie ein zusätzliches Kriterium für den Einstieg in eine medikamentöse Therapie dar.
Was ist ein Aderlass und wie wird er durchgeführt?
Der etwas altertümlich klingende Ausdruck Aderlass (Phlebotomie) steht für die Entnahme einer größeren Menge Blut, ähnlich wie bei einer Blutspende. In der Regel werden pro Aderlass 250 bis 500 ml Blut entnommen. Bei gefährdeten Patienten (höheres Alter, Gefäßprobleme, Herzmuskelschwäche) sollte die Blutentnahme in geringeren Mengen und größeren Abständen erfolgen, um nicht möglicherweise durch eine zu abrupte Therapie Komplikationen zu provozieren.
Was bewirkt der Aderlass?
Der Aderlass reduziert das Blutvolumen, wodurch sich meist der erhöhte Hämatokrit schnell und effektiv absenken lässt. Längerfristig sollte der Hämatokrit auf unter 45 Prozent eingestellt werden.
Gestützt wird diese Empfehlung durch die Ergebnisse einer Studie aus Italien. Diese konnte belegen, dass sich erst ab einem Hämatokrit unterhalb dieses Zielwerts die Zähflüssigkeit des Blutes und damit die Thromboseneigung wirksam reduzieren lassen und dass höhere Hämatokritwerte mit einer gesteigerten Thromboserate verbunden waren.
Wie häufig soll ein Aderlass durchgeführt werden?
Je nach Höhe des Hämatokrits können zu Beginn der Behandlung unter Umständen mehrere Aderlässe hintereinander in zwei- bis dreitägigen Abständen notwendig sein. Später reicht es meist aus, den Hämatokritwert durch gelegentliche Aderlässe im Zielbereich zu halten.
Thrombozytenzahl kann unter der Aderlasstherapie steigen
Es ist nicht ungewöhnlich, dass unter der Aderlasstherapie die Thrombozytenzahl steigt. Hierbei handelt es sich um eine normale Reaktion des Körpers, die auch auf den durch die Aderlässe induzierten Eisenmangel zurückzuführen ist.
Wie kann ich den Aderlass erleichtern?
Aderlässe können mitunter sehr schwierig sein, weil das Blut aufgrund seiner Viskosität kaum fließt. Daher ist es empfehlenswert, vor jedem Aderlass reichlich zu trinken (möglichst Wasser oder Kräutertee), um die Fließfähigkeit des Blutes zu verbessern. Danach sollten Patientinnen ebenfalls reichlich trinken, um den Flüssigkeitsverlust auszugleichen.
Manche Ärzte kombinieren den Aderlass mit Flüssigkeitszufuhr, indem sie nach dem Aderlass über den bereits gelegten Venenzugang eine physiologische Kochsalzlösung infundieren. Dies ist insgesamt schonender für den Organismus, weil der Flüssigkeitsverlust unmittelbar ausgeglichen wird. Diese Vorgehensweise empfiehlt sich vor allem bei Patientinnen, die während des Aderlasses oder danach über Unwohlsein oder Schwindelgefühle klagen.
Patienten mit schwer zugänglichen Venen, die Angst vor einem »Stochern« in der Armbeuge haben, können – in der Apotheke erhältliche – Pflaster oder Salben zur Betäubung der Einstichstelle nutzen. Damit sie ihre Wirkung zum richtigen Zeitpunkt entfalten, sollten Pflaster oder Salbe ein bis zwei Stunden vor dem Aderlass aufgetragen werden.
Welche Bedeutung hat Eisenmangel infolge der Aderlasstherapie?
Die Aderlasstherapie bewirkt kurzfristig eine Verringerung des Blutvolumens, langfristig dient sie aber der Induktion eines Eisenmangels. Dieser ist gewünscht, da ohne Eisen der Körper nicht mehr so schnell neue rote Blutkörperchen produzieren kann. Anders als bei Gesunden wird der Mangel in der Regel nicht behandelt, denn von außen zugeführtes Eisen würde die Neuproduktion von Erythrozyten anregen und damit den Hämatokrit rasch wieder ansteigen lassen. Zudem beeinflusst der Eisenmangel die Dynamik zwischen Erythrozytenzahl, Hämatokrit und Hämoglobinkonzentration, sodass die Abstände zwischen den Aderlässen (Aderlassfrequenz) im Laufe der Zeit größer werden. Nur in besonderen Einzelfällen – etwa, wenn der Eisenmangel zu massiven Beschwerden führt – kann unter engmaschiger ärztlicher Kontrolle eine vorsichtige orale Eisengabe erfolgen. Es ist insgesamt sehr wichtig, dass die behandelnde Ärztin die unerwünschten Begleiterscheinungen des Eisenmangels im Auge behält, da schwere Symptome den Einsatz einer zytoreduktiven Therapie zur Verminderung der Aderlasshäufigkeit erforderlich machen können, obwohl eine solche Therapie aus anderen Gründen nicht notwendig erscheint.
Alternative zum Aderlass: Erythrozytapherese
Die Erythrozytapherese ist eine alternative Methode zum Aderlass. Bei der Erythrozytapherese werden lediglich die roten Blutkörperchen entfernt, während alle sonstigen Blutbestandteile nach Auftrennung direkt wieder zurück gegeben werden. Die Auftrennung der Erythrozyten erfolgt in einem Zellseparator und dauert etwa eine Stunde, in welcher der Patient mit dem Gerät verbunden bleibt. Technisch ist die Erythrozytapherese mit der Dialyse (Blutwäsche) vergleichbar, bei der ebenfalls bestimmte Substanzen aus dem Blut entfernt werden. Die Erythrozytapherese ist sicher und effektiv und beschädigt die im Körper belassenen Blutbestandteile nicht. Das Verfahren eignet sich insbesondere für Patienten, bei denen der Hämatokrit gefährlich erhöht ist, z.B. zu Beginn der Erkrankung oder vor einer Notfall-OP. Vorteilhaft ist, dass meist weniger Sitzungen pro Jahr notwendig sind als Aderlässe. Aufgrund des hohen apparativen Aufwands sowie der hohen Kosten wird das Verfahren oft nur in Notfallsituationen eingesetzt.
Wann reicht die Aderlasstherapie nicht mehr aus?
Sind dauerhaft in sehr kurzen Abständen Aderlässe notwendig, wird in der Regel eine medikamentöse Therapie zur Verminderung der Zellbildung in Erwägung gezogen (zytoreduktive Therapie).
Gleiches gilt bei sehr hohen Thrombozyten- (> 1 Mio.) oder hohen Leukozytenzahlen (> 15 G/l), da sich diese nicht durch Aderlässe senken lassen. Eine stark vergrößerte, möglicherweise Beschwerden verursachende Milz, kann ebenso Anlass für den Einstieg in eine zellreduzierende Therapie sein, mit dem Ziel, die Milz wieder zu verkleinern. Außerdem können Symptome, welche sich nicht durch Aderlässe verbessert haben, ein Grund sein, eine medikamentöse Therapie einzuleiten.
Thrombozytenaggregationshemmer wie ASS, Clopidogrel u.ä.
Thrombozytenaggregationshemmer (TAH) hindern die Blutplättchen daran, miteinander zu verklumpen und setzen so die Wahrscheinlichkeit einer Thrombusbildung herab.
Acetylsalicylsäure (ASS) und alternative TAH
Der bei PV am häufigsten verordnete Wirkstoff dieser Art ist Acetylsalicylsäure (ASS). ASS verbessert bei vielen Patienten Mikrozirkulationsstörungen, die sich als Durchblutungsstörungen an Händen und Füßen, Schwindel, Kopfschmerzen oder Sehstörungen bemerkbar machen können. In der Referenzstudie (ECLAP-Studie) erwies sich die Einnahme von ASS als wirkungsvoll, da sie das Auftreten von arteriellen und schweren venösen Thrombosen reduzierte, weshalb sie grundsätzlich allen PV-Betroffenen empfohlen wird, bei denen medizinisch nichts gegen eine Einnahme spricht (keine Kontraindikationen).
Wichtig zu wissen:
ASS ist in Deutschland in einer Standarddosierung von 500mg pro Tablette als frei verkäufliches Schmerzmittel erhältlich und wird von Patientinnen oft unbedacht angewendet. Da der Wirkstoff die Blutungsneigung verstärkt, sollte die Einnahme aber unbedingt mit dem Hämatologen abgestimmt werden!
Gegenanzeigen
Eine relative Gegenanzeige für ASS besteht immer dann, wenn Betroffene eine erhöhte Blutungsneigung zeigen oder unter Magen- und Darmgeschwüren leiden.
Die sehr hohe Thrombozytenzahl von mehr als 1 bis 1,5 Mio./µl spricht ebenfalls gegen die Einnahme von ASS. In diesen Fällen liegt häufig ein erworbenes von-Willebrand-Syndrom vor und damit eine erhöhte Blutungsneigung, weshalb ASS nur in begründeten Ausnahmefällen, bzw. erst nach Absenkung der Thrombozytenzahl zum Einsatz kommen darf.
Alternativen
Einige wenige Menschen leiden an einer Unverträglichkeit oder sprechen auf ASS nicht an. Mittlerweile gibt es mit den Wirkstoffen Clopidogrel, Prasugrel oder Ticagrelor einige Alternativen, die nach sorgfältiger Rücksprache mit den behandelnden Ärztinnen angewandt werden können. Niedrig dosiertes Heparin kann ebenfalls eine Alternative darstellen.
Einnahmeform
Tabletten, i. d. R. täglich (50 -100 mg). Da jeder Mensch unterschiedlich auf ASS reagiert, kann es ggf. notwendig sein, die Dosis und den Verabreichungszyklus (z.B. nur jeden 2. Tag) für jeden Patienten anzupassen. Mit der magenschonenderen Variante ASS protect kann man Magenproblemen evtl. vorbeugen.
Zellreduzierende Medikamente
Eine medikamentöse Therapie zur Reduzierung der Zellzahlen (zytoreduktive Therapie) ist immer dann angezeigt, wenn Betroffene älter als 60 Jahre sind oder es in der Vergangenheit – entweder vor der Diagnose, aber auch trotz Aderlass und ASS – bereits zu thromboembolischen Ereignissen gekommen ist.
Es gibt verschiedene Wirkstoffe, die sowohl mit Aderlässen als auch untereinander kombinierbar sind. Ziele der Behandlung sind, die Blutwerte in den Ziel bzw. Normbereich zu bringen, insbesondere Hämatokrit und Thrombozyten, und die Nebenwirkungen möglichst gering zu halten.
Unter Umständen ist es sinnvoller, zellreduzierende Medikamente niedrig zu dosieren und gelegentlich einen Aderlass vorzunehmen, statt auf Aderlässe um den Preis sehr hoher Dosierungen zu verzichten. Hier hat der Arzt die Aufgabe, Risiken und Nebenwirkungen gegeneinander abzuwägen und dies mit der Patientin zu besprechen.
Da die Blutwerte nach dem Absetzen der zellreduzierenden Medikamente wieder ansteigen, wenn auch unterschiedlich schnell, ist – außer in Einzelfällen nach Interferonbehandlung – in der Regel eine dauerhafte Erhaltungstherapie erforderlich. Die Dosierungen der einzelnen Wirkstoffe sind individuell verschieden und können sich im Verlauf der Erkrankung ändern. Deshalb sind selbst bei einer gut eingestellten medikamentösen Behandlung regelmäßige Blutwertkontrollen nötig.
HU – Hydroxyurea (Handelsnamen: Litalir, Syrea, Hydrea)
Hydroxyurea (Handelsnamen: Litalir, Syrea, Hydrea) gilt seit Jahrzehnten als Standardtherapie in der Behandlung von MPN-Erkrankungen. Bei HU handelt es sich um ein sogenanntes Zellteilungsgift (Zytostatikum), das die Funktion des Knochenmarks einschränkt und so die Zahl der Blutzellen reduziert. HU wirkt aber nicht nur auf die Thrombozyten, sondern hemmt ebenso die Produktion der weißen Blutkörperchen (Leukozyten) und der roten Blutkörperchen (Erythrozyten). Sind die Erythrozyten allerdings schon rückläufig und zeigt sich eine Anämie, kann diese durch HU noch verstärkt werden. Hier ist der Nutzen von HU abzuwägen und die Dosierung gegebenenfalls anzupassen. Nach dem Absetzen der Therapie steigen die Blutwerte in der Regel sehr schnell wieder an.
Gegenanzeigen
HU sollte bei jüngeren Betroffenen wegen des Einflusses von Zytostatika auf die Keimbahn (Eizellen und Spermien) und der Nebenwirkungen auf Haut und Schleimhäute zurückhaltend eingesetzt werden. Ein erhöhtes Leukämierisiko durch HU ist nicht sicher belegt. Bei etwa fünf bis zehn Prozent der mit HU behandelten Patienten bleibt die gewünschte zellreduzierende Wirkung aus (Resistenz).
Einnahmeform
Tabletten beziehungsweise Kapseln (à 500 mg), i. d. R. täglich
Mögliche Nebenwirkungen
Es können leichter Haarausfall und Hautveränderungen auftreten. Patienten sollten intensive Sonneneinstrahlung meiden beziehungsweise auf einen angemessenen Sonnenschutz achten.
In einigen Fällen können als Folge der HU-Einnahme Unterschenkelgeschwüre auftreten. In diesem Fall sollte das Medikament sofort abgesetzt werden. Die Geschwüre bilden sich dann in der Regel wieder zurück.
Die längerfristige Behandlung mit HU geht mit einem erhöhten Risiko für Tumoren der Haut einher, somit sollten insbesondere Patientinnen mit Hautkrebsvorstufen (z. B. Aktinische Keratosen) oder bösartigen Hauttumoren (z. B. Basaliome) sich regelmäßig einer Hautärztin vorstellen, ein jährliches Hautscreening wird allen Nutzern von HU empfohlen.
IFN – Interferon-alpha (Handelsnamen: Pegasys, Besremi)
Interferon (Handelsnamen: Pegasys, Besremi) ist ein hormonähnlicher Botenstoff (Zytokin) und kann die Produktion von Blutzellen im Knochenmark bei PV und anderen MPN verlangsamen und die gesteigerten Zellzahlen im peripheren Blut absenken.
IFN scheint auf Wachstumsfaktoren und andere Botenstoffe, die Zytokine, zu wirken und durch Hemmung von faserbildenden Zellen die Wahrscheinlichkeit des Übergangs einer PV in eine Myelofibrose zu reduzieren.
Allerdings bleibt bei etwa 10 bis 20 Prozent der Patienten die gewünschte zellreduzierende Wirkung aus (Resistenz). Wenn sie jedoch eintritt, ist sie nachhaltiger als die von HU. Interferon ist derzeit von allen zytoreduktiv wirkenden Medikamenten die Substanz, welche die Mutationslast (Menge an mutiertem JAK2) am stärksten und nachhaltigsten absenken kann. Inwieweit die Substanz dadurch den natürlichen Verlauf der Erkrankung beeinflussen und somit eventuell auch das Überleben verlängern kann, wird intensiv beforscht.
Gegenanzeigen
Interferon sollte bei Patientinnen mit Schilddrüsenerkrankung nur dann verordnet werden, wenn diese mit konventioneller Behandlung kontrolliert werden kann.
Nicht selten treten neurologische und psychische Probleme auf, bei Patienten mit psychischen Vorerkrankungen wie Depressionen können sich diese deutlich verstärken. Diese Problematik muss intensiv beachtet werden, eventuell kann es sinnvoll sein, Patienten vor und unter Therapie regelmäßig zu einem Psychiater oder Psychologen zu schicken. Nach Absetzen bzw. Dosisreduktion von Interferon gehen diese Nebenwirkungen häufig schnell wieder zurück.
Vorsichtiger Einsatz ist ebenfalls bei schwerer Leber- oder Nierenerkrankung angeraten.
Einnahmeform
Ähnlich wie Insulin bei Diabetikern, muss Interferon mit Fertigspritzen vom Patienten selbst unter die Haut (subkutan) gespritzt werden, bei der pegylierten Form einmal wöchentlich oder alle 14 Tage, im Behandlungsverlauf manchmal auch in noch größeren Abständen.
Durch die Pegylierung des Wirkstoffs bei neueren Präparaten wie Pegasys oder Besremi wird der Abbau des Medikaments im Körper verlangsamt, sodass in größeren Abständen gespritzt werden kann. Zusätzlich kommt es zu einer relativ konstanten Wirkstoffkonzentration im Körper, wodurch Nebenwirkungen reduziert werden können.
Mögliche Nebenwirkungen
Sehr häufige Nebenwirkungen von (pegylierten) Interferonen, die mehr als eine von zehn Personen betreffen können, sind niedrige Spiegel der weißen Blutkörperchen (Leukozyten) und der Blutplättchen (Thrombozyten).
Mögliche weitere Nebenwirkungen sind grippeähnliche Symptome nach der Injektion (Fieber, Muskel- und Knochenschmerzen, Schüttelfrost, Übelkeit, Durchfall), Rötungen oder Reizungen an der Injektionsstelle, Haarausfall, Hautreaktionen, Depressionen, Gewichtsverlust, Konzentrationsstörungen und Störungen der Schilddrüsenfunktion.
Ein Einschleichen der Therapie mit niedrigen, langsam ansteigenden Dosierungen kann die Nebenwirkungen mildern. Nach einer Gewöhnungsphase gehen diese bei vielen Patientinnen deutlich zurück.
Wichtig zu wissen:
Für PV-Patientinnen, die schwanger sind oder einen Kinderwunsch haben und eine zellreduzierende Behandlung benötigen, ist Interferon aktuell das Mittel der Wahl und wird in den Leitlinien der DGHO empfohlen. Auch für jüngere Patienten empfiehlt die aktuelle Behandlungsleitlinie den Einsatz von Interferon.
AG – Anagrelid (Handelsnamen: Xagrid, Thromboreductin, Agrelin)
Anagrelid (Handelsnamen: Xagrid, Thromboreductin, Agrelin) senkt ausschließlich die erhöhte Thrombozytenzahl. Es ist eigentlich nur für die Essentielle Thrombozythämie (ET) zugelassen, wird jedoch in wenigen Fällen außerhalb der Zulassung (Off-Label-Use) eingesetzt.
Die Substanz hemmt die Reifung der Vorstufenzellen der Thrombozyten im Knochenmark (Megakaryozyten) und schränkt damit die Neubildung von Thrombozyten ein, sodass ihre Anzahl im Blut sinkt. Es wirkt weitgehend plättchenspezifisch und beeinflusst nicht die Bildung anderer Blutzellen. Somit ist Anagrelid als Einzeltherapie bei einer PV in der Regel nicht sinnvoll einsetzbar, sondern ggf. in Kombination mit anderen Medikamenten nach individueller Abwägung.
Die Effektivität, mit der Anagrelid die Thrombozytenzahl senkt, ist mit der von HU vergleichbar. Ebenso wie bei der Behandlung mit HU, steigen die Thrombozyten nach Absetzen der Therapie im Allgemeinen schnell wieder an.
Die Ansprechrate bei Patientinnen mit MPN in der Literatur lag durchschnittlich bei etwas über 80%, erreicht aber in manchen Studien deutlich mehr als 90%.
Ein abruptes Absetzen von Anagrelid kann in Einzelfällen zu thrombotischen Komplikationen führen, weshalb es bei einem Therapiewechsel ausgeschlichen bzw. überlappend mit einer neuen Therapie eingesetzt werden sollte.
Wichtig zu wissen:
Studien haben gezeigt, dass unter der Kombination von Anagrelid und ASS die Blutungsneigung zunimmt. Daher sollten Patienten – von begründeten Ausnahmefällen abgesehen – die beiden Medikamente insbesondere zu Beginn der Therapie bei hohen Thrombozytenwerten nicht parallel einnehmen. Dieses gilt es im Verlauf der Therapie immer wieder abzuwägen.
Einnahmeform
Tabletten beziehungsweise Kapseln, i. d. R. täglich
Mögliche Nebenwirkungen
sind Kopfschmerzen, Durchfälle, Ödem-Bildung, Schwindel und Herzrasen. Das Nebenwirkungsrisiko sinkt deutlich, wenn der Einstieg in die Therapie langsam, mit einer geringen Dosierung erfolgt, die nach und nach gesteigert wird (Einschleichen).
Wichtig zu wissen:
Patientinnen, die unter Herzrhythmusstörungen und/oder Herzinsuffizienz leiden, sollten Anagrelid nur nach sorgfältiger kardiologischer Untersuchung und einer strengen Risiko-Nutzen-Abwägung einnehmen. Der Wirkstoff führte in der Vergangenheit in Einzelfällen zu schwerwiegenden Herzproblemen, wovon in seltenen Fällen auch junge Patienten ohne Vorerkrankungen am Herzen betroffen waren.
Mutationsorientierte Therapien
Die Entdeckung der JAK2-Mutation hat nicht nur das Verständnis für die MPN verbessert, sondern stellt die Basis für neue Therapieoptionen dar, die auf den speziellen Defekt (Mutation) ausgerichtet sind. Die sogenannten JAK-Inhibitoren Ruxolitinib und Fedratinib, zugelassen für PMF, und Ruxolitinib auch als Zweitlinientherapie für PV, bieten neben den altbewährten Wirkstoffen erstmals eine zielgerichtete medikamentöse Therapieoption. Seit 2012 ist Ruxolitinib in Deutschland zugelassen. Inzwischen steht mit Fedratinib ein weiterer JAK-Inhibitor zur Verfügung, der das Behandlungsspektrum erweitert, allerdings bisher für PV nicht zugelassen ist.
Ruxolitinib (Handelsname: Jakavi)
Der Tyrosinkinase-Inhibitor (TKI) Ruxolitinib (Handelsname: Jakavi) greift in einen Signalübertragungsweg der Zelle ein und hemmt die Aktivität bestimmter Enzyme (Januskinase 1 und 2). Diese sind nur noch eingeschränkt in der Lage, der Zelle das Signal zur Teilung zu geben. Hierdurch sinkt die Zahl der im Blut zirkulierenden Zellen.
Ruxolitinib ist in der Lage, die Milzgröße zu reduzieren und die Lebensqualität deutlich zu verbessern, indem er konstitutionelle Symptome wie chronische Erschöpfung (Fatigue) und Nachtschweiß spürbar lindert. Zudem kann eine effektive Kontrolle des Hämatokrits mit Ruxolitinib erreicht werden.
Ruxolitinib (Handelsname: Jakavi) ist der erste in einer Reihe von Wirkstoffen, der nach der Entdeckung der JAK2-Mutation im Jahre 2005 entwickelt wurde. 2012 erhielt er in Deutschland die Zulassung für die Behandlung der PMF. Seit Frühjahr 2015 liegt die erweiterte Zulassung vor, die eine Behandlung von PV-Patientinnen in der Zweitlinientherapie ermöglicht.
Im Unterschied zur Wirkstoffklasse der Zytostatika wirkt er nicht auf die Zellteilung, sondern greift in einen Signalübertragungsweg der Zelle ein. Das Medikament hemmt die Aktivität bestimmter Enzyme (Januskinase 1 und 2), sodass diese nur noch eingeschränkt in der Lage sind, der Zelle das Signal zur Teilung zu geben. Hierdurch sinkt die Zahl der im Blut zirkulierenden Zellen.
Neuere Studienergebnisse deuten darauf hin, dass Ruxolitinib möglicherweise die sogenannte Mutationslast zurückdrängen kann. Zudem wurde bei Patienten mit Myelofibrose ein positiver Einfluss auf die Prognose nachgewiesen, in einigen Fällen kann es die Fibrose zurückdrängen. Interessanterweise wirkt Ruxolitinib sowohl bei JAK2-positiven, als auch bei JAK2-negativen Patienten.
Gegenanzeigen
Ruxolitinib darf nicht von Schwangeren eingenommen werden und wird bei Patienten mit Thrombozyten unter 50.000/µl nicht empfohlen.
Einnahmeform
Tabletten (à 5, 10, 15 oder 20 mg), i. d. R. 2 x täglich
Die ärztliche Verordnung orientiert sich an der Zahl der Thrombozyten, die zu Beginn der Einnahme mindestens 50.000/µl betragen sollten. Die empfohlene Anfangsdosis bei PV ist 10 mg, zweimal täglich.
Nebenwirkungen
In bisherigen Studien traten unter Ruxolitinib nur wenige schwerwiegende Nebenwirkungen auf. Bekannt ist, dass die Werte sämtlicher Blutzellreihen (Thrombozyten, Erythrozyten, Leukozyten) abfallen. Erreichen sie ein sehr niedriges Niveau, muss die Dosierung angepasst oder die Behandlung gegebenenfalls unterbrochen oder in Einzelfällen beendet werden. Nach dem Ende der Behandlung erreichen die Blutwerte in der Regel schnell wieder das alte Niveau.
Weitere mögliche Nebenwirkungen sind Gewichtszunahme und Verdauungsbeschwerden (Blähungen, Verstopfung). Außerdem sollten Arzt und Patientin auf bakterielle und virale Infektionen achten (Tuberkulose, Gürtelrose/Herpes-Zoster, Entzündungen der Harnwege).
Wichtig zu wissen:
- Es ist streng darauf zu achten, Ruxolitinib nicht abrupt abzusetzen, sondern langsam auszuschleichen, da sonst ein Absetzsyndrom mit schwerwiegenden Symptomen auftreten kann.
- Impfungen gegen Pneumokokken und Herpes-Zoster vor Therapiebeginn sollten in Erwägung gezogen werden. Zudem sollte ggf. über antivirale und antibakterielle Prophylaxen nachgedacht werden. Da unter Ruxolitinib eine Virushepatitis wieder aufflammen kann, sollte vor Einleitung einer Therapie eine Hepatitisserologie erfolgen und ggf, eine antivirale Therapie parallel eingeleitet werden.
- Im Falle einer Coronavirus-Infektion darf Ruxolitinib keinesfalls abgesetzt werden, da es in der COVID-Pandemie nach Absetzen zu einer deutlich erhöhten Sterblichkeit von MF-Patienten kam.
Kombinationstherapie mit Ruxolitinib
Die Kombination von Ruxolitinib mit anderen Arzneimitteln ist Schwerpunkt aktueller klinischer Studien. Es ist nicht unwahrscheinlich, dass Kombinationen zukünftig als Therapieoption zugelassen und ihren Weg in den Behandlungsalltag finden werden.
Wichtig zu wissen:
Aktuell befinden sich weitere JAK-Inhibitoren in klinischen Phase-3-Studien. Zwar werden diese Medikamente für die Behandlung der PMF entwickelt, sofern eine Zulassung erfolgt, stehen sie aber zumindest in Sonderfällen im Off-Label Use ebenfalls für die Behandlung der PV zur Verfügung, was aufgrund der nicht identischen Wirkungsweise und Nebenwirkungen in manchen Fällen hilfreich sein könnte.
Behandlungsmöglichkeiten bei Juckreiz
Juckreiz (Pruritus) ist für viele PV-Betroffene ein quälendes Symptom, das die Lebensqualität erheblich beeinträchtigen kann. Die Ursachen sind unklar, werden aber ebenfalls untersucht. Bei Patienten, bei denen sich der Juckreiz unter Aderlasstherapie nicht signifikant bessert, sollte eine Behandlung mit zellreduzierenden Medikamenten wie Ruxolitinib, Interferon oder HU erwogen werden.
Patientinnen, die gegen den Juckreiz Antihistaminika eingenommen haben, berichten, dass der gewünschte Erfolg häufig ausblieb. Eine histaminarme Ernährung kann jedoch Linderung bringen.
Tipps zur Bekämpfung des Juckreizes aus unserem Mitgliederforum
- Tritt der Juckreiz ausschließlich nach dem Baden oder Duschen auf, helfen möglicherweise Wechselduschen kombiniert mit anschließendem Einreiben der noch feuchten Haut mit Öl oder Körperlotion, ebenso können ureahaltige Produkte helfen.
- Einigen Betroffenen hilft der Besuch eines Sonnenstudios, nachdem sie beobachtet haben, dass der Juckreiz im Sommer, vermutlich durch den Einfluss des Sonnenlichts (UV-Strahlung), milder ausfällt als im Winter.
- Im Winter empfiehlt es sich, die Kleidung zunächst auf der Heizung anzuwärmen, und erst dann anzuziehen.
- Einem Mitglied hilft ein warmes Bad mit Meersalz,
- einem anderen das Auflegen von Gurkenscheiben, bzw. sogar der Verzehr.
Regelmäßige Kontrollen sind wichtig
Die Behandlungsleitlinien der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO) empfehlen folgende Untersuchungen, um den Verlauf der PV dauerhaft zu kontrollieren:
- Blutuntersuchung, bei der die Abstände je nach Schwere der Erkrankung und Therapie zwischen wenigen Tagen (z. B. bei Therapieeinstieg) und mehreren Monaten (bei stabilem Verlauf) variieren
- eine halbjährliche umfassendere Untersuchung mit ausführlichem Arztgespräch, um den Krankheitsverlauf, mögliche Komplikationen und Therapienebenwirkungen zu überwachen
- etwa jährlicher Ultraschall, u. a. wegen möglicher Milzvergrößerung.
Fazit
Keine kurative Behandlung
Trotz neuer, hoffnungsvoller Ansätze in der Medikamentenforschung gehört die PV zu den Erkrankungen, für die es – abgesehen von der Blutstammzell-Transplantation – derzeit keine kurative (heilende) Behandlung gibt.
Vielmehr muss man von einer medizinischen Begleitung der Krankheit sprechen, bei der die Aufgabe der Ärztin primär darin besteht, die Symptomatik zu behandeln und den Verlauf im Auge zu behalten. Einzelne Therapieansätze werden aber aktuell darauf untersucht, ob sie ggf. den Verlauf der Erkrankung beeinflussen können.
Der Erhalt beziehungsweise die Wiederherstellung der Lebensqualität sollte in der Zusammenarbeit von Arzt und Patientin im Vordergrund stehen.
»Primum non nocere« – »zuallererst: Füge keinen Schaden zu.«
Einer der weltweit anerkannten Hämatologen, Dr. Jerry Le Pow Spivak aus den USA, erinnert für die Behandlung der PV an einen sehr alten ärztlichen Grundsatz (um 50 n. Chr.): »Primum non nocere« – »zuallererst: Füge keinen Schaden zu.«
Dr. Spivak legt diesen Grundsatz folgendermaßen aus: »Die Diagnose muss korrekt sein, die Therapie sollte ebenso sicher wie effektiv und die Behandlung nicht schlimmer als die Erkrankung selbst sein.« (Übersetz. d. D.W.) Diese Forderung macht deutlich, dass es in der Begleitung der PV für die Ärztin keine Strategie gibt, die sich auf jeden Patienten zu jeder Zeit pauschal anwenden lässt. Ziel muss vielmehr sein, die individuell richtige Behandlung zu finden, die dem einzelnen Betroffenen am meisten nutzt und seine Lebensqualität so lange wie möglich erhält.
MPN-Register
Zusätzlich zur Erforschung neuer Medikamente ist es für die Steigerung des Erkenntnisgewinns zum Krankheitsbild PV unverzichtbar, die Erfahrungen mit bisherigen Behandlungsstrategien systematisch zu erfassen und auszuwerten. Vor diesem Hintergrund begrüßt das mpn-netzwerk ausdrücklich die Einführung des MPN-Registers und empfiehlt allen Betroffenen, durch ihre Teilnahme aktiv zur Vermehrung des Wissens über MPN- Erkrankungen und deren Behandlung beizutragen.
Austausch mit anderen Betroffenen
Der Austausch mit anderen Betroffenen in Selbsthilfegruppen oder -organisationen kann helfen, das Hier und Jetzt nicht zu vergessen. Das mpn-netzwerk lädt Sie daher abschließend herzlich ein, sich am Austausch im Forum sowie auf den Regional- und den Jahrestreffen des Vereins zu beteiligen.
Wir danken Dr. Susanne Isfort, Aachen, für ihre fachliche Beratung und das Gegenlesen dieses Textes.
Quellen:
- Broschüre mpn-netzwerk e.V.
- Onkopedia (zuletzt 12/2022)
https://www.onkopedia.com//onkopedia/de/onkopedia/guidelines/polycythaemia-vera-pv - Leben mit PV
https://www.leben-mit-pv.de/ (zuletzt 11/2022) - Kompetenznetz Leukämien
https://www.kompetenznetz-leukaemie.de/content/e60/e13935/e39609/index_ger.html - Mikroskopie-Abbildung – mit freundlicher Genehmigung aus: Torsten Haferlach, Hämatologische Erkrankungen, Atlas und diagnostisches Handbuch, Springer-Verlag Berlin Heidelberg 2020, ISBN 978-3-662-59546-6.
verwendete externe Links
- Onkopedia-Leitlinien PV
https://www.onkopedia.com//onkopedia/de/onkopedia/guidelines/polycythaemia-vera-pv - Webseite GSG-MPN
https://www.cto-im3.de/gsgmpn/ - Webseite DLH der Deutschen Leukamie- und Lymphomhilfe/Informationsblätter
https://www.leukaemie-hilfe.de/infothek/eigene-publikationen/infoblaetter/

